Chronisch-entzündliche Darmerkrankungen
Entzündungsfördernde regulatorische T-Lymphozyten als therapeutischer Angriffspunkt bei Morbus Crohn
Chronisch-entzündliche Darmerkrankungen sind für die Betroffenen sehr belastend und erhöhen das Risiko für Darmkrebs. PD Dr. Robyn Laura Kosinsky vom Bosch Health Campus in Stuttgart identifizierte zusammen mit Forschenden aus den USA fehlgesteuerte regulatorische T-Zellen als wichtige Entzündungstreiber bei Morbus Crohn. Mit Hilfe eines epigenetisch wirkenden Medikaments gelang es zudem, die ursprüngliche Funktion der Zellen wiederherzustellen.
Wiederkehrende Bauchschmerzen und anhaltender Durchfall, oft in Kombination mit Fieber, Appetitlosigkeit, Übelkeit und Erbrechen; dies alles können Anzeichen einer chronisch-entzündlichen Darmerkrankung (CED) sein. Weltweit sind hiervon sechs bis acht Mio. Menschen betroffen, davon zwei Mio. in Europa.1) In neun von zehn Fällen handelt es sich um Morbus Crohn (MC) oder Colitis ulcerosa (CU). Trotz der sehr ähnlichen Symptome unterscheiden sich die Krankheiten in ihrer Manifestation grundlegend: CU breitet sich gleichmäßig vom Enddarm aus und betrifft nur die Darmschleimhaut; Morbus Crohn hingegen tritt fleckenförmig vorwiegend am Übergang zwischen Dünn- und Dickdarm auf und kann sich durch alle Schichten der Darmwand ziehen. Bei beiden Formen ist allerdings die Barrierefunktion des Darms eingeschränkt, und das Immunsystem spielt eine wesentliche Rolle.
Die genaue Pathogenese der CEDs ist noch nicht vollständig geklärt, eindeutig ist aber, dass mehrere Faktoren zusammenkommen müssen.1) Neben einer genetischen Prädisposition scheinen Nikotinkonsum (bei MC) oder Antibiotikaeinsatz in der Kindheit und insbesondere die mit der westlichen Ernährungsweise einhergehende Veränderung des Mikrobiomgleichgewichts (Dysbiose) im Darm eine Rolle zu spielen. Langfristig kann die chronische Entzündung die Funktion des Darms so stark beeinträchtigen, dass die Aufnahme von Mineralstoffen wie Eisen und Calcium oder fettlöslichen Vitaminen verringert ist. Außerdem besitzen die Betroffenen ein erhöhtes Risiko für Darmkrebs, und häufig treten zusätzlich Beschwerden außerhalb des Verdauungstraktes auf, beispielsweise an Gelenken, Haut, Augen oder Leber.
T-Lymphozyten regulieren die Immunantwort
 PD Dr. Robyn Laura Kosinsky (hinten stehend) untersucht mit ihrer Arbeitsgruppe am Robert Bosch Centrum für Tumorerkrankungen in Stuttgart die molekularen Grundlagen von chronisch-entzündlichen Darmerkrankungen. © Bosch Health Campus, Akshay Kanakan
PD Dr. Robyn Laura Kosinsky (hinten stehend) untersucht mit ihrer Arbeitsgruppe am Robert Bosch Centrum für Tumorerkrankungen in Stuttgart die molekularen Grundlagen von chronisch-entzündlichen Darmerkrankungen. © Bosch Health Campus, Akshay Kanakan„Ich möchte die Rolle des Immunsystems bei Morbus Crohn besser verstehen“, berichtet PD Dr. Robyn Laura Kosinsky, seit 2022 Gruppenleiterin am Robert Bosch Centrum für Tumorerkrankungen in Stuttgart. Zu diesem Zweck verbrachte sie, gefördert durch ein Mildred-Scheel-Stipendium der Deutschen Krebshilfe, zwei Jahre in den USA an der Mayo Clinic in Rochester, Minnesota. Dort konzentrierte sie sich auf T-Lymphozyten, die zusammen mit den antikörperproduzierenden B-Lymphozyten und den natürlichen Killerzellen eine Untergruppe der weißen Blutkörperchen bilden.
T-Lymphozyten lassen sich in T-Killerzellen und T-Helferzellen unterteilen. Erstere sind direkt an der Erkennung und Zerstörung von infizierten oder veränderten Körperzellen beteiligt und durch das Oberflächenprotein CD8 gekennzeichnet. T-Helferzellen hingegen exprimieren CD4- Moleküle und besitzen keine zytotoxische Aktivität. Sie koordinieren die erworbene Immunantwort, indem sie spezielle Botenstoffe ausschütten, sogenannte Zytokine. Diese stimulieren andere Immunzellen wie Makrophagen, B-Lymphozyten und zytotoxische T-Zellen und sind unerlässlich für eine effektive Immunreaktion.
Eine weitere Gruppe (< 10 Prozent) stellen die ebenfalls CD4-positiven regulatorischen T-Zellen (Tregs) dar, die allerdings inhibitorische Zytokine sezernieren und die Aktivität des Immunsystems drosseln. Dies ist einerseits wichtig, um die Immunantwort nach einer Weile wieder abzuschalten, und andererseits notwendig für die Ausbildung der Selbsttoleranz. Bei chronisch-entzündlichen Erkrankungen ist die Balance zwischen Aktivierung und Unterdrückung gestört, sodass das Immunsystem über das Ziel hinausschießt, weshalb zur Therapie vor allem Immunsuppressiva eingesetzt werden.
Entzündungsfördernde Tregs entdeckt
Um die Rolle der CD4+-T-Lymphozyten bei Morbus Crohn zu ermitteln, wählten die Forschenden um Kosinsky eine spezielle Vorgehensweise. Die Molekularbiologin erläutert: „Da Gewebeproben eine Vielzahl unterschiedlicher Zelltypen enthalten, haben wir zunächst alle CD4-positiven Zellen angereichert. Mit Hilfe der Einzelzell-RNA-Sequenzierung konnten wir dann die abgelesenen Gene in jeder Zelle bestimmen und detaillierte Analysen durchführen.“ Im Vergleich zu gesunden Personen ist der Anteil der Tregs in den Proben der Erkrankten deutlich erhöht. „Dies ist nicht ungewöhnlich, bzw. sollte so sein, da es Aufgabe der Tregs ist, die Entzündung zu bekämpfen. Warum ihnen das nicht gelingt, ist bisher nicht vollständig geklärt“, sagt sie.
Aus diesem Grund untersuchten die Wissenschaftlerinnen und Wissenschaftler genauer, was innerhalb der Zellen passiert. Anhand des Expressionsprofils, also der Gesamtheit der in der Zelle vorhandenen Genprodukte, stellten sie fest, dass sich die Tregs von Gesunden und Erkrankten stark unterscheiden. Insgesamt konnten sie fünf verschiedene Untergruppen definieren. Die Mehrzahl der Tregs aus Gesunden besaß ein Expressionsprofil, wie es bei normaler Funktion der Zellen zu erwarten war. Bei den Erkrankten hingegen gehörten weniger als drei Prozent dieser Gruppe an, die überwiegende Zahl (fast 60 Prozent) zeigte ein deutlich verändertes Expressionsprofil, wie es mit der Aktivierung entzündungsfördernder Signalwege einhergeht.
„Die Tregs aus Morbus Crohn-Patienten reagieren ungewöhnlich auf den Botenstoff Tumornekrosefaktor-alpha (TNF-a), der von den umgebenden Immunzellen sezerniert wird. Wir konnten zehn verschiedene Gene identifizieren, die spezifisch nur in Tregs von Erkrankten hochreguliert sind“, schildert die Erstautorin der Studie, die im April 2024 im renommierten Fachjournal Gastroenterology erschienen ist.2) „Und es ist uns gelungen, einen Wirkstoff zu finden, mit dem sich diese Entwicklung wieder rückgängig machen lässt.“
Epigenetisch wirkendes Medikament programmiert Tregs wieder um
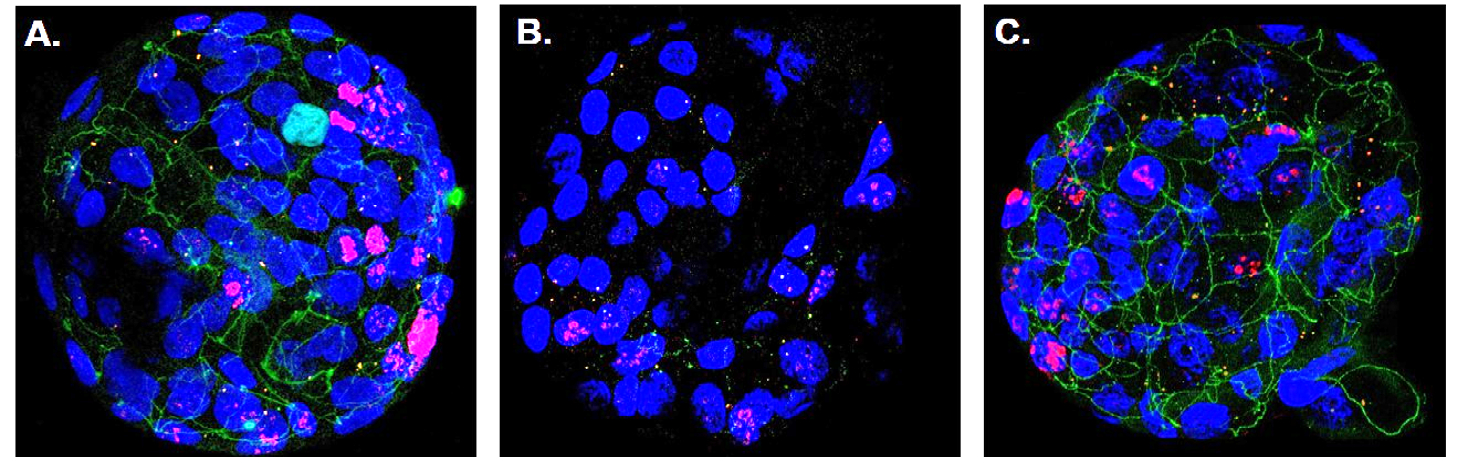 Immunfluoreszenz-Aufnahme von humanen Colon-Organoiden mit blau leuchtenden Zellkernen. Bei Co-Kultivierung mit gesunden Tregs bilden sich Tight Junctions (grün) aus, die die Epithelzellen eng zusammenhalten (A). In Gegenwart von entzündungsfördernden Tregs sind kaum Tight Junctions vorhanden, sodass größere Zellzwischenräume entstehen (B). Kultivierung mit entzündungsfördernden Tregs und zusätzliche Gabe von Vorinostat führt wieder zur Ausbildung von Tight Junctions (C). © Gastroenterology, Elsevier Inc.
Immunfluoreszenz-Aufnahme von humanen Colon-Organoiden mit blau leuchtenden Zellkernen. Bei Co-Kultivierung mit gesunden Tregs bilden sich Tight Junctions (grün) aus, die die Epithelzellen eng zusammenhalten (A). In Gegenwart von entzündungsfördernden Tregs sind kaum Tight Junctions vorhanden, sodass größere Zellzwischenräume entstehen (B). Kultivierung mit entzündungsfördernden Tregs und zusätzliche Gabe von Vorinostat führt wieder zur Ausbildung von Tight Junctions (C). © Gastroenterology, Elsevier Inc.Um die Fehlregulation wieder rückgängig zu machen nutzten die Forschenden ein bioinformatisches Analyseprogramm, das anhand der Genexpressionsunterschiede zwischen Gesunden und Erkrankten eine Medikamentendatenbank auf Substanzen durchsucht, die das Ablesen dieser Gene verändern. Dabei stießen sie auf Vorinostat, einen in den USA zugelassenen Wirkstoff. Dieser beeinflusst die epigenetischen Mechanismen im Zellkern, indem er die Aktivität sogenannter Histon-Deacetylasen (HDAC) hemmt.3) In Zellkulturexperimenten zeigte sich, dass Vorinostat die Expression der entzündungsfördernden Gene in Tregs drastisch reduziert, sodass die Zellen wieder in der Lage sind, die Vermehrung anderer T-Lymphozyten zu unterdrücken.
Dieser Effekt bestätigte sich auch in Versuchen mit humanen Colon-Organoiden. Wurden die organähnlichen Mikrostrukturen zusammen mit proinflammatorischen Tregs kultiviert, kam es zu einem starken Verlust der Kontaktstellen zwischen den Epithelzellen, den Tight Junctions. Die Durchlässigkeit der Epithelschicht erhöhte sich signifikant, ein Phänomen, das auch in der Darmschleimhaut von Morbus Crohn-Betroffenen beobachtet wird. Durch Zugabe von Vorinostat ließ sich dies verhindern.
„Durch die von uns entdeckten entzündungsfördernden Tregs und ihre Umprogrammierung mit Hilfe von Vorinostat könnten sich neue Möglichkeiten bei der Therapie von CEDs ergeben“, erläutert Kosinsky. Hinweise auf eine antiinflammatorische Wirkung des bisher nur zur Behandlung des fortgeschrittenen kutanen T-Zelllymphoms zugelassenen Medikaments gab es bereits vorher,3) die aktuellen Forschungsarbeiten decken nun wichtige molekulare Grundlagen auf.
In der neu aufgebauten Arbeitsgruppe in Stuttgart wurden vor allem die bioinformatischen Analysen erbracht, während Kosinsky die zugrundeliegenden Laborarbeiten mit Hilfe des Teams der Mayo Clinic in den USA durchführte. „Inzwischen haben wir vor Ort ein umfassendes Modellsystem etabliert, mit dem wir auch den Einfluss anderer Immunzellen auf die Durchlässigkeit des Darmepithels untersuchen können“, berichtet die Gruppenleiterin. „Außerdem wollen wir weitere HDAC-Inhibitoren testen, die geringere Nebenwirkungen haben.“ In diesem Zusammenhang hebt die Wissenschaftlerin hervor, dass sich die gesamte Forschung am Bosch Health Campus, zu dem neben dem Robert Bosch Centrum für Tumorerkrankungen noch das Robert Bosch Krankenhaus sowie weitere Forschungsinstitute gehören, eng an den Bedürfnissen der Klinik orientiert.