Neue Behandlungsverfahren: DNA-Origami-basierte Nanobausteine steuern Immunantwort präzise
Mit Bottom-up-synthetischer-Immunologie zu neuartigen Therapieansätzen
Moderne Therapien zur Bekämpfung von Infektionskrankheiten oder Krebs beziehen zunehmend das körpereigene Immunsystem ein. Mit Hilfe innovativer Bottom-up-Ansätze auf dem Gebiet der synthetischen Immunologie wollen mehrere Forschungsgruppen der Universität Heidelberg neue Behandlungsverfahren entwickeln, mit denen sich die Immunantwort präziser als bisher lenken lässt.
Bei der Erkennung und Bekämpfung von Krankheitserregern oder Krebszellen benötigt unser Immunsystem gelegentlich Unterstützung. Schutzimpfungen beispielsweise sensibilisieren die Immunabwehr im Voraus gegenüber speziellen Pathogenen, sodass diese bei Kontakt schnell identifiziert und zielgerichtet eliminiert werden können. Tumorzellen lassen sich allerdings nicht so leicht aufspüren, denn die meisten unterscheiden sich nur geringfügig von gesunden Zellen. Zudem besitzen sie häufig Mechanismen, die die Erkennung durch das Immunsystem verhindern bzw. die Abwehrreaktion blockieren können.
Einige der aktuellen Krebstherapien zielen deshalb darauf ab, diese Immunevasion auszuhebeln. Dabei verfolgt die Immunonkologie verschiedene Ansätze: Checkpoint-Inhibitoren binden hemmende Signalmoleküle auf der Oberfläche von Krebszellen und neutralisieren sie, sodass das Immunsystem wieder angreifen kann. Bispezifische Antikörper hingegen vernetzen Immun- und Tumorzellen und lösen durch diese räumliche Nähe eine Aktivierung der Abwehrreaktion aus. Bei der CAR-T-Zelltherapie wiederum werden T-Immunzellen der erkrankten Person gentechnisch so verändert, dass sie in der Lage sind, Krebszellen zu erkennen und zu vernichten. Die unterschiedlichen Methoden sind bemerkenswert erfolgreich, können aber auch schwerwiegende Nebenwirkungen haben.
Unterstützung des Immunsystems mit Hilfe von DNA-Origami
 Prof. Dr. Kerstin Göpfrich kreiert mit ihrer Arbeitsgruppe am ZMBH neuartige molekulare Bausteine, um zelluläre Strukturen und langfristig eine komplette künstliche Zelle von Grund auf zusammenzubauen. © Kathrin Hall, ZMBH
Prof. Dr. Kerstin Göpfrich kreiert mit ihrer Arbeitsgruppe am ZMBH neuartige molekulare Bausteine, um zelluläre Strukturen und langfristig eine komplette künstliche Zelle von Grund auf zusammenzubauen. © Kathrin Hall, ZMBH„Moderne, zellbasierte Krebstherapien wie die CAR-T-Zelltherapie beruhen auf einer Top-down-Strategie. Mit dieser kann man durchaus viel erreichen, die Verfahren sind aber sehr teuer und die Wirkung nicht vollständig kontrollierbar“, erläutert Prof. Dr. Kerstin Göpfrich vom Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH). „Wir verfolgen deshalb einen Bottom-up-Ansatz, bei dem wir einfache molekulare Bausteine nutzen, um zelluläre Strukturen und langfristig eine komplette künstliche Zelle von Grund auf zusammenzubauen.“ Mit ihrer Arbeitsgruppe Biophysical Engineering of Life hat die Physikerin bereits viele wichtige Grundlagen dafür geschaffen.
Die von den Forschenden hergestellten neuartigen Nanobausteine basieren vor allem auf DNA-Origami. Bei dieser Methode werden lange DNA-Einzelstränge – meist viralen Ursprungs - mit Hilfe von kurzen synthetischen DNA-Strängen zu komplexen dreidimensionalen Gebilden gefaltet. Diese können spezifische Funktionen erfüllen – auch solche, die in natürlichen Zellen von Proteinen übernommen werden.1)
Die Wissenschaftlerin schildert: „Mit DNA-Origami lässt sich die molekulare Hardware verhältnismäßig einfach und preisgünstig kreieren. Und da wir nur gut definierte Bauteile verwenden, haben wir die volle Kontrolle über das System und können gezielt Funktionen ein- und ausschalten. Bei der Top-down-Vorgehensweise hingegen enthalten die synthetischen Zellen viel unberechenbaren evolutionären Ballast.“
Um die vielversprechenden Bottom-up-Engineering-Ansätze der synthetischen Biologie auf immunologische Fragestellungen zu übertragen, wurde 2022 das Spotlight-Projekt „Synthetische Immunologie“ ins Leben gerufen, eine interdisziplinäre Kooperation verschiedener Heidelberger Forschungsinstitute aus den Bereichen Biologie, Physik, Medizin, Chemie und Pharmazie. Durch Einsatz modernster Technologien sollen neue Erkenntnisse über das Immunsystem gewonnen sowie Möglichkeiten der Manipulation erarbeitet werden.
Neuartige Impfstoffe durch Bottom-up-Ansatz
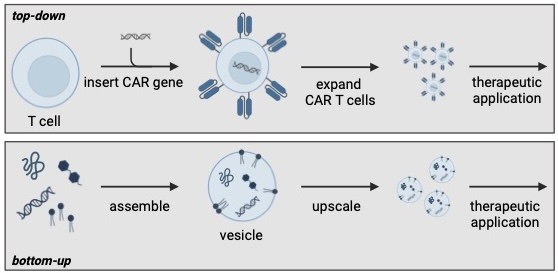 Die CAR-T-Zelltherapie nutzt körpereigene Immunzellen, die im Labor gentechnisch verändert werden, sodass sie Krebszellen erkennen und zerstören können (Top-down-Ansatz). Beim Bottom-up-Verfahren werden aus künstlichen Bausteinen therapeutisch wirksame, zellähnliche Vesikel von Grund auf neu konstruiert. © Oliver Fackler, Michael Platten und Kerstin Göpfrich
Die CAR-T-Zelltherapie nutzt körpereigene Immunzellen, die im Labor gentechnisch verändert werden, sodass sie Krebszellen erkennen und zerstören können (Top-down-Ansatz). Beim Bottom-up-Verfahren werden aus künstlichen Bausteinen therapeutisch wirksame, zellähnliche Vesikel von Grund auf neu konstruiert. © Oliver Fackler, Michael Platten und Kerstin GöpfrichIn einem Beitrag, der 2024 im Fachjournal Nature Nanotechnology erschien, beschreiben Göpfrich und Kollegen das große Potenzial des neuen Forschungsfeldes.2) Ein Beispiel für erste Erfolge sind die Impfstoffe gegen das Coronavirus SARS-CoV-2, die aus künstlich hergestellten mRNA-Molekülen verpackt in Lipid-Nanopartikeln bestehen. In Heidelberg sollen jetzt Impfstoffe basierend auf DNA-Origami entwickelt werden. „Dabei konstruieren wir ein Gerüst aus DNA, auf dem wir präzise verschiedene Antigene [Strukturen, die eine Immunantwort auslösen] positionieren können, entsprechend ihrer Anordnung auf der Oberfläche von Pathogenen“, erläutert die Wissenschaftlerin das innovative Vorhaben. „Bisherige Impfstoffe enthalten zumeist nur einzelne lösliche Antigene; bei einigen Krankheiten wie Malaria oder HIV reicht das aber nicht aus, um eine Immunität zu erzeugen.“ Die Forschenden sind zuversichtlich, dass sie dies mit der Bottom-up-Nanotechnologie erreichen können.
Peptid-Boronsäuren eröffnen vielfältige Möglichkeiten
 Prof. Dr. Christian Klein, Juniorprof. Dr. Franziska Thomas und der Doktorand Marius Werner entwickelten an der Universität Heidelberg eine schnelle und einfache Methode zur Herstellung von Peptid-Boronsäuren. © Julian Brinkhofer
Prof. Dr. Christian Klein, Juniorprof. Dr. Franziska Thomas und der Doktorand Marius Werner entwickelten an der Universität Heidelberg eine schnelle und einfache Methode zur Herstellung von Peptid-Boronsäuren. © Julian BrinkhoferProtein- und Peptid-Engineering stellt einen weiteren wichtigen Bereich der synthetischen Immunologie dar. Hiermit beschäftigen sich die ebenfalls am Spotlight-Projekt beteiligten Arbeitsgruppen von Juniorprofessorin Dr. Franziska Thomas am Organisch-Chemischen Institut und Prof. Dr. Christian Klein am Institut für Pharmazie und Molekulare Biotechnologie der Universität Heidelberg. Bei der Erkennung von infizierten oder auch malignen Körperzellen spielen kurze Peptide, die von erreger- bzw. tumorspezifischen Proteinen abstammen, eine entscheidende Rolle. Sie werden dem Immunsystem - gebunden an spezielle Proteine, die MHC-Moleküle (für Major Histocompatibility Complex) - auf der Zelloberfläche präsentiert und lösen eine zytotoxische Immunreaktion aus. Da diese Immunantwort aber häufig sehr schwach ist, wollen die Forschenden sie mit Hilfe synthetischer Peptide verstärken.
Auf dem Weg dorthin entwickelten die Teams ein neues Verfahren zur Herstellung von Peptid-Boronsäuren, also Peptiden, die eine Boronsäure-Gruppe (-B(OH)2) enthalten. „Peptid-Boronsäuren können reversible kovalente Bindungen eingehen, was sie attraktiv für pharmazeutische Anwendungen macht“, führt Thomas aus. „Im Vergleich zu nicht-modifizierten Peptiden entstehen zunächst sehr stabile Interaktionen. Mit der Zeit hydrolysieren die Bindungen allerdings wieder, das heißt sie spalten sich im wässrigen Milieu auf.“ Diese Eigenschaft eröffnet vielfältige Optionen: „Durch Verknüpfung mit Trägermolekülen wie etwa Dextran-Nanopartikeln, lassen sich die Peptid-Boronsäuren zu ihrem Bestimmungsort transportieren und dort sukzessive, also mit Depotwirkung, freisetzen“, veranschaulicht Klein. „Wir können zudem Peptid-Protein-Wechselwirkungen gezielter modulieren und so zukünftig bessere Inhibitoren entwickeln oder beispielsweise immunogene Peptide fester an MHC-Moleküle binden.“
Power der Festphasensynthese
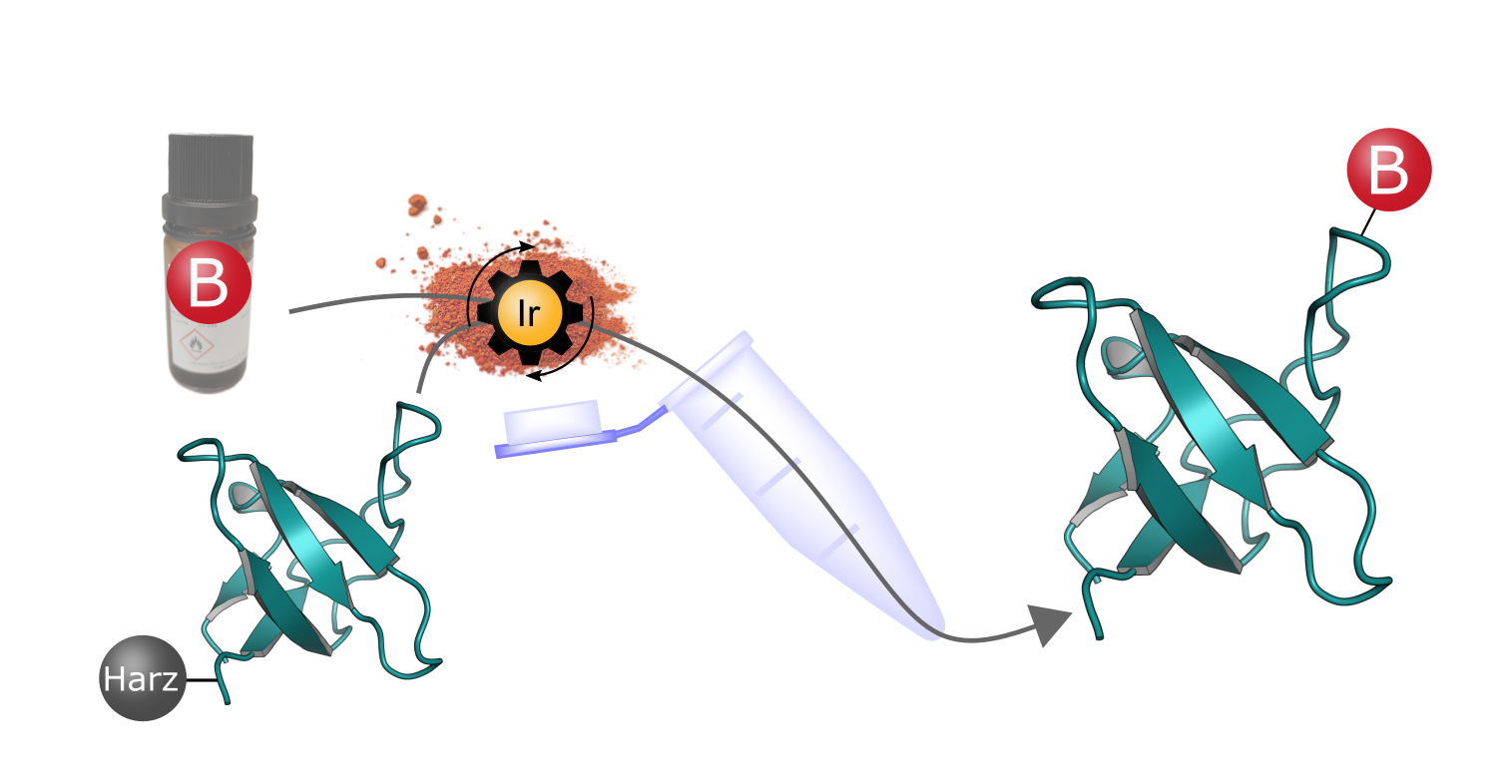 Das innovative Syntheseverfahren basiert auf harzgebundenen Peptiden, an deren reaktive Seitenketten mit Hilfe eines Iridium-Katalysators (Ir) Boronsäuregruppen (B) angefügt werden. Die gebildeten Peptid-Boronsäuren besitzen besondere Eigenschaften, die neue pharmazeutische Anwendungen ermöglichen können. © Marius Werner (basierend auf der Proteinstruktur PDB 1CKB)
Das innovative Syntheseverfahren basiert auf harzgebundenen Peptiden, an deren reaktive Seitenketten mit Hilfe eines Iridium-Katalysators (Ir) Boronsäuregruppen (B) angefügt werden. Die gebildeten Peptid-Boronsäuren besitzen besondere Eigenschaften, die neue pharmazeutische Anwendungen ermöglichen können. © Marius Werner (basierend auf der Proteinstruktur PDB 1CKB)Die Synthese von Peptid-Boronsäuren war bisher äußerst kompliziert und langwierig. Das vom Doktoranden Marius Werner ausgearbeitete Verfahren, das ebenfalls 2024 im Fachjournal Advanced Science veröffentlicht wurde, ist nicht nur deutlich schneller, sondern es können damit auch komplexere Moleküle gebildet werden.3) Basierend auf der klassischen Festphasen-Peptidsynthese wird im ersten Schritt die gewünschte Aminosäurekette gebunden an ein festes Harz hergestellt. Das Anfügen der Boronsäuregruppe erfolgt dann durch Hydroborierung reaktiver Doppel- oder auch Dreifachbindungen der Seitenketten. Thomas hebt hervor: „Der Prozess ist sehr effizient und sowohl für kurze als auch lange Peptide geeignet.“
Die Boronsäure ist eine sehr vielfältige funktionelle Gruppe und kann weiter verändert oder auch vollständig ersetzt werden, sodass sich eine große Bandbreite an Anwendungsmöglichkeiten ergibt. Mit diesem Handwerkszeug wollen die Forschenden zukünftig vor allem immunologische Fragestellungen bearbeiten.
Aufgrund der räumlichen Nähe zwischen Grundlagenforschung und Klinik in Heidelberg finden die Wissenschaftlerinnen und Wissenschaftler ideale Voraussetzungen für interdisziplinäre Kooperationen, wovon alle Projekte der synthetischen Immunologie enorm profitieren.