Prostatakrebs ist mit 26 Prozent die häufigste diagnostizierte Krebserkrankung beim Mann. Ist der Tumor bereits metastasiert, gilt er bislang als nicht heilbar. Die Krebsimmuntherapie liefert einen schlauen Ansatzpunkt, die Zielstruktur Tumor mit körpereigenen Mitteln anzugreifen und dabei das gesunde Gewebe in Ruhe zu lassen. Kontinuierlich laufen Studien zu Wirksamkeit und Sicherheit von Immuntherapien zur Bekämpfung solider Tumoren, um die mit vielen Nebenwirkungen verknüpften Standardtherapien abzulösen. Um den Tumor zu lokalisieren, braucht es Antikörper, die ihn zweifelsfrei identifizieren. Die Arme des Antikörpers sind dabei gegen Oberflächenproteine (Antigene) der Krebszellen gerichtet. Bispezifische Antikörper sind von Zellen unabhängige, im Labor hergestellte Konstrukte, die in Lebewesen natürlicherweise nicht vorkommen. Sie sind durch ihren Aufbau in der Lage, zwei verschiedene Zielantigene zu erkennen und beispielsweise neben dem Tumor gleichzeitig an Zellen des Immunsystems, wie T-Zellen, zu binden.
Antikörperentwicklung durch TWYCE und BiconY
 Ihr Ziel ist die Verbesserung der Krebsimmuntherapie: Prof. Dr. Helmut Salih, Prof. Dr. Gundram Jung und Dr. Martin Pflügler (v.l.n.r.) gründeten die Firma TWYCE GmbH und entwickeln neue bispezifische Antikörper am am Medizinischen Institut der Uni Tübingen sowie am Deutschen
Ihr Ziel ist die Verbesserung der Krebsimmuntherapie: Prof. Dr. Helmut Salih, Prof. Dr. Gundram Jung und Dr. Martin Pflügler (v.l.n.r.) gründeten die Firma TWYCE GmbH und entwickeln neue bispezifische Antikörper am am Medizinischen Institut der Uni Tübingen sowie am Deutschen
Krebsforschungszentrum (DKFZ) in Heidelberg. © Mattia BalsaminiDie T-Zell-basierte Immuntherapie ist inzwischen fest in der Krebsmedizin verankert. Bei der CAR-T-Zell- sowie der bispezifischen Antikörpertherapie werden Antikörper benutzt, um T-Zellen zu stimulieren und gezielt auf den Tumor zu lenken. Die CAR-T-Zelltherapie ist insofern aufwendiger, als dass hierfür den Patienten eigene T-Zellen entnommen, genetisch manipuliert und wieder zurückgegeben werden müssen. Dadurch verliert man mehrere Wochen, die vielleicht entscheidend sind. „Wenn die Zeit drängt, wäre es schon sehr gut, wenn man Arzneimittel sozusagen off-the-shelf einsetzen könnte“, sagt der Geschäftsführer der Firma TWYCE GmbH, Dr. Martin Pflügler. „Die bispezifischen Antikörper sind sehr vielversprechend, denn sie sind wirtschaftlich, für jeden rasch zugänglich und per Infusion verabreichbar.“
TWYCE wird von der Bundesagentur für Sprunginnovationen (SPRIN-D) gefördert, wobei SPRIN-D Projekte in der angewandten Forschung unterstützt, die innovative Lösungen für gesellschaftliche Herausforderungen liefern. Zwischen TWYCE und SPRIN-D ist die eigens dafür gegründete Firma BiconY geschaltet, da eine Bundesinstitution nicht in private Firmen investieren darf. In BiconY fließt das Geld aus dem Bundeshaushalt, in TWYCE werden die Forschungsinhalte festgelegt, und beide haben einen Kooperationsvertrag. TWYCE gilt als Gamechanger in der Krebsimmuntherapie für solide Tumore. Das Unternehmen verfolgt den kombinatorischen Ansatz, durch zwei funktionell voneinander abhängige bispezifische Antikörper die Wirkung in der T-Zell-basierten Immuntherapie zu verbessern und gleichzeitig die Nebenwirkungen zu reduzieren.
Das Trio der Firmengründer und Forscher der Klinischen Kooperationseinheit (KKE) Translationale Immunologie der Universität Tübingen und des DKFZ besteht aus Prof. Dr. Gundram Jung, Prof. Dr. Helmut Salih und Dr. Martin Pflügler. Die Ärzte Jung und Salih fokussieren auf die Entwicklung und die Translation der Therapeutika in die Klinik, während Pflügler sich als Pharmazeut in der Produktion der Antikörper und mit den regulatorischen Anforderungen gut auskennt.
Monotherapie mit einem Antikörper oft nicht ausreichend
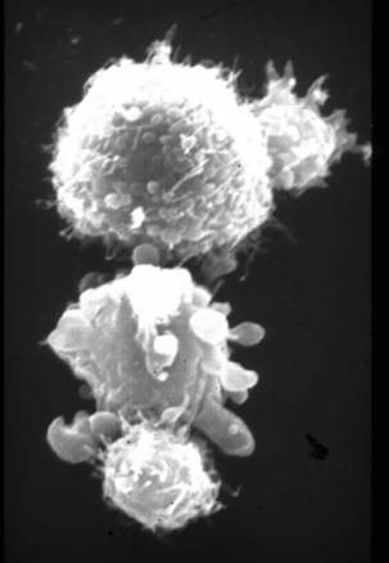 Die zwei kleineren T-Zellen (im Bild ganz unten und rechts oben) attackieren die zwei größeren Tumorzellen, wobei sich die untere Krebszelle bereits in der Lyse befindet. © Prof. Dr. Gundram Jung, TWYCE GmbH
Die zwei kleineren T-Zellen (im Bild ganz unten und rechts oben) attackieren die zwei größeren Tumorzellen, wobei sich die untere Krebszelle bereits in der Lyse befindet. © Prof. Dr. Gundram Jung, TWYCE GmbHNun haben die drei Forscher ein innovatives Therapiekonzept entwickelt, das sie rasch in die Klink bringen wollen. Erfolge blieben bisher auf verschiedene Blutkrebsarten beschränkt, da in der Regel solide Tumoren für Effektorzellen des Immunsystems außerhalb des Blutgefäßsystems schwer zugänglich sind und es überdies keine spezifischen Antigene gibt, die explizit nur auf dem Tumor vorkommen. „Der Tumor bildet kein eigenes Antigen“, sagt Pflügler. „Er besteht nur aus körpereigenen Zellen und Proteinen.“
Eine weitere Schwierigkeit ist die Aufrechterhaltung der Aktivierung der T-Zellen bei der Immunantwort gegen den Krebs. In einer vorausgegangenen Studie bekamen Patienten mit fortgeschrittenem Prostatakarzinom einen bispezifischen Antikörper verabreicht, der gleichzeitig das prostataspezifische Membranantigen (PSMA) sowie den Rezeptor CD3 auf T-Zellen bindet und so eine Nähe beider Zellen herstellt, um die Reaktion zu induzieren. Als zuverlässiger Biomarker für Prostatakrebs gilt dabei ein erhöhter Wert des prostataspezifischen Antigens (PSA), der auch früh Hinweise auf ein Rezidiv liefert, selbst wenn Prostata und Tumor bereits entfernt wurden. Die Patienten sprachen zwar gut auf diese Therapie an, allerdings nur kurz. „Es funktioniert eigentlich gut: Die T-Zellen werden aktiviert, greifen den Tumor an, aber schalten dann sehr schnell wieder ab“, sagt Pflügler. „Das Immunsystem nach der Reaktion wieder runterzufahren vermeidet seine Überaktivierung.“ (Die Folge einer überschießenden Immunreaktion wäre das so genannte Zytokin-Release-Syndrom (CRS), das sogar lebensbedrohlich werden kann.) Die T-Zellen werden also nach kurzer Zeit inaktiv und beenden die Attacke gegen den Tumor.
Für die Patienten mit fortgeschrittenem Karzinom war dies nicht ausreichend, um den Tumor zu bekämpfen. Durch eine weitere Studie untersuchen Jung, Salih und Pflügler aktuell, ob die Monotherapie bei Patienten mit geringerer Tumorlast genügen könnte, um der Krebszellen Herr zu werden. „Diese Patienten sind im biochemischen Rezidiv, die Prostata wurde entnommen, aber man kann am PSA-Wert sehen, dass noch irgendwo Tumorzellen sein müssen“, erklärt der Forscher und ist zuversichtlich, dass hier ein bispezifischer Antikörper ausreicht.
Verbesserte Effizienz durch Doppelstimulation
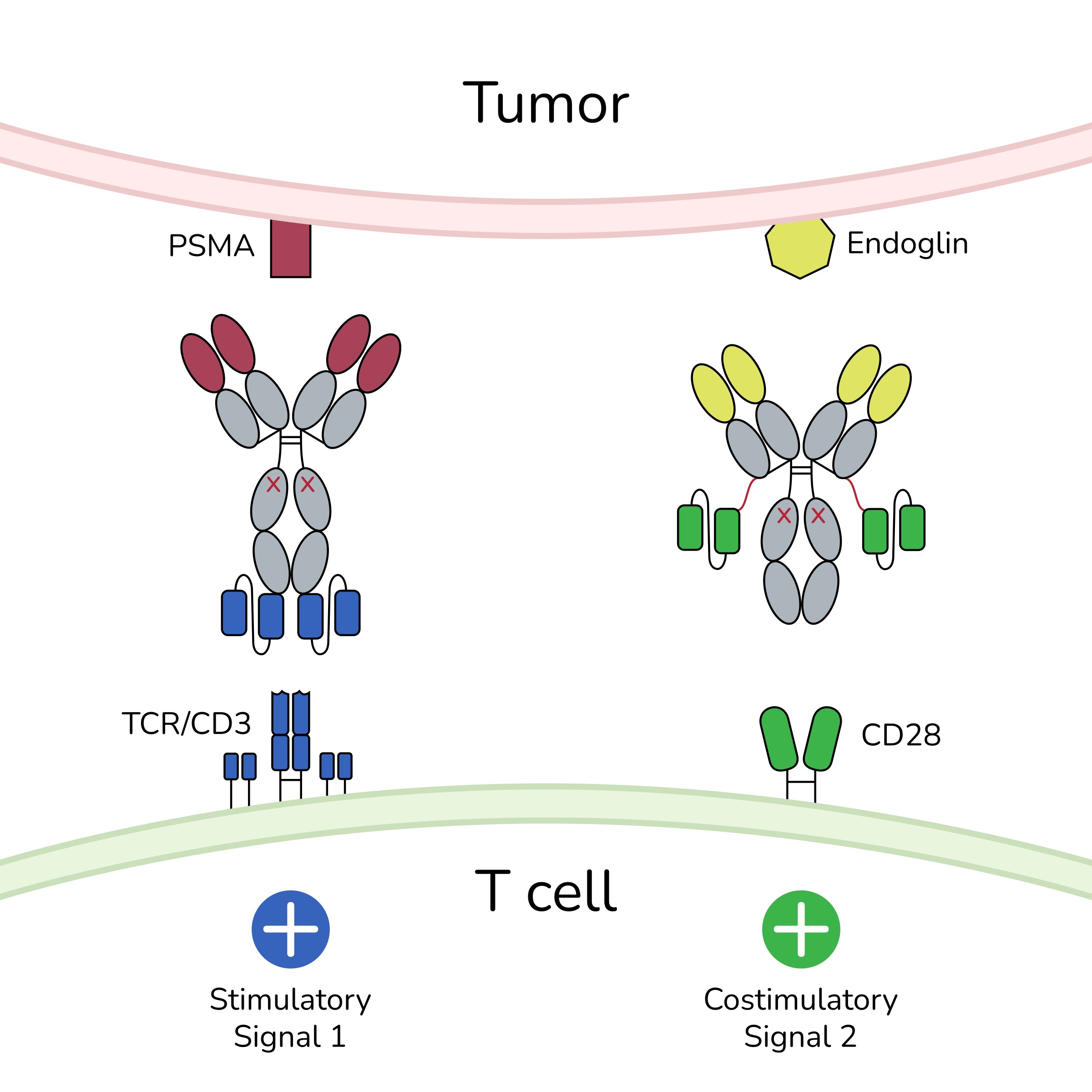 Der bispezifische Antikörper schafft gemeinsam mit dem bispezifischen Kostimulator über die Rezeptoren der T-Zelle (CD3 und CD28) und die Antigene der Tumorzelle (PSMA und Endoglin) eine räumliche Nähe der beiden Zellen. Die entstehenden Signale lösen eine Reaktion aus, bei der die Lyse der Tumorzelle induziert wird. © TWYCE GmbH
Der bispezifische Antikörper schafft gemeinsam mit dem bispezifischen Kostimulator über die Rezeptoren der T-Zelle (CD3 und CD28) und die Antigene der Tumorzelle (PSMA und Endoglin) eine räumliche Nähe der beiden Zellen. Die entstehenden Signale lösen eine Reaktion aus, bei der die Lyse der Tumorzelle induziert wird. © TWYCE GmbHFür jene Patienten mit höherer Tumorlast hat Pflügler mit der TWYCE bereits die nächste Studie am Start. Diese soll je nach Bewältigung der vielen regulatorischen Auflagen Ende 2024 oder Anfang 2025 beginnen und zeigen, wie die genannten Schwächen der Monotherapie überwunden werden können. Die Idee ist, einen zweiten bispezifischen Antikörper als Kostimulator einzusetzen, der ein zweites Ziel an Tumor und T-Zelle erkennt und gleichzeitig die Reaktion über längere Zeit aufrechterhält. Die Zugänglichkeit wird erhöht, indem die Zielantigene nicht nur auf Tumor, sondern auch auf Tumorgefäßen adressiert werden.
„Damit ist der Tumor leichter erreichbar, denn die Gefäße werden von den Immunzellen geöffnet, aber eben nur am Tumor“, meint Pflügler. Um das Abflauen der Reaktion zu verhindern, wird mit dem zweiten Antikörper auf der T-Zelle neben CD3 ein zweites Signal durch den CD28-Rezeptor generiert. „Mit Hilfe des Signals zwei, das eine kostimulierende Wirkung hat, wird verhindert, dass die T-Zelle wieder runterfährt und vermittelt so eine längere Reaktion“, so Pflügler.
Die auf dem Tumorgewebe liegenden Antigene PSMA und Endoglin kommen nur in Prostatakarzinomen gemeinsam vor und werden durch die beiden Antikörperkonstrukte mit den T-Zellen zusammengeführt. Der Kostimulator funktioniert nur, wenn auch das Signal eins (durch CD3 Antikörper) vorhanden ist. Die dadurch ausgelöste Signalkaskade hat die gewünschte Lyse der bösartigen Zellen zur Folge. Die Konsequenz ist eine zweifache Antitumorwirkung bei gleichzeitiger Minimierung der Toxizität für gesunde Zellen. Denn ein erheblicher Vorteil dabei ist, dass Antikörper eins durch die Kostimulation deutlich niedriger dosiert werden kann. Hauptnebenwirkung hierbei ist wie bei allen Immuntherapien das CRS, aber nur gering, temporär und vor allem lokal am Tumor induziert. „Je höher die Tumorlast ist, desto stärker auch die Zytokinausschüttung, weil auch mehr T-Zellen aktiviert werden“, erklärt Pflügler. „Wobei Nebenwirkung ja auch in diesem Fall Wirkung bedeutet.“ Wenn es gut läuft, könnte die Therapie in rund sechs Jahren im Klinikalltag angekommen sein und lässt sich optimal mit anderen Antikörper- oder Peptid-basierten Therapien kombinieren.