Vicinity Bio: Optimierung der Krebsdiagnostik
Umfassende histologische Diagnostik dank hochdimensionaler Bildgebung und Künstlicher Intelligenz
Die mikroskopische Begutachtung von Gewebeproben ist vor allem in der Tumordiagnostik unverzichtbar. Durch neuartige Bildgebungsverfahren in Kombination mit maschinellem Lernen kann das Tübinger Unternehmen Vicinity Bio jetzt aus Schnittpräparaten umfangreiche Datensätze einzelner Zellen erstellen. Dies unterstützt die Suche nach zielgerichteteren Therapien und ein besseres Verständnis von Abläufen und Funktionen in Geweben und Tumoren.
Die Devise „Schneller, höher, weiter“ gilt nicht nur im Sport, sondern durchaus auch bei der Analyse medizinischen Probenmaterials. Damit aus kleinen Mengen an Blut oder Gewebe in kürzester Zeit möglichst viele Daten gewonnen und detailliert ausgewertet werden können, arbeiten Forschende kontinuierlich an der Verbesserung der einzelnen Arbeitsschritte. Vor allem bei der Behandlung von Tumoren oder schweren Infektionen sind schnelle, präzise und umfassende Diagnosen entscheidend für den Erfolg. Hierfür müssen allerdings alle Beteiligten aus den unterschiedlichen Fachrichtungen eng zusammenarbeiten.
 PD Dr. Kilian Wistuba-Hamprecht, Prof. Dr. Dr. Christian Schürch und Prof. Dr. Manfred Claassen (von links nach rechts) bilden das wissenschaftliche Gründungsteam des in Tübingen ansässigen Unternehmens Vicinity Bio, das neuartige Bildgebungsverfahren und Künstliche Intelligenz nutzt, um aus Gewebeproben hochdimensionale Bilder sowie umfangreiche Einzelzell-Datensätze zu erstellen. © Vicinity Bio
PD Dr. Kilian Wistuba-Hamprecht, Prof. Dr. Dr. Christian Schürch und Prof. Dr. Manfred Claassen (von links nach rechts) bilden das wissenschaftliche Gründungsteam des in Tübingen ansässigen Unternehmens Vicinity Bio, das neuartige Bildgebungsverfahren und Künstliche Intelligenz nutzt, um aus Gewebeproben hochdimensionale Bilder sowie umfangreiche Einzelzell-Datensätze zu erstellen. © Vicinity BioIm Bereich der Histologie, also der mikroskopischen Untersuchung von Gewebeproben, bietet das im November 2024 in Tübingen gegründete Unternehmen Vicinity Bio jetzt eine einzigartige Dienstleistung an. „Von der Aufarbeitung des Probenmaterials über die Visualisierung einer Vielzahl von Biomarkern bis hin zu KI-getriebener Datenauswertung befindet sich bei uns alles in einer Hand“, hebt der Biochemiker und Immunologe PD Dr. Kilian Wistuba-Hamprecht hervor, CEO des Start-ups. Zusammen mit dem Pathologen und Tumorimmunologen Prof. Dr. Dr. Christian Schürch (CMO) und dem Klinischen Bioinformatiker und Biochemiker Prof. Dr. Manfred Claassen (CTO) bildet er das wissenschaftliche Gründungsteam. „Unsere Schnittmenge bietet so viel Potenzial, das wollen wir über die wissenschaftliche Kooperation hinaus nutzen und einem breiten Publikum zur Verfügung stellen. Dabei haben wir sowohl die Forschung als auch die Patientenversorgung im Fokus.“
Umfassende immunhistochemische Färbung von Schnittpräparaten
Biologisches Gewebe besteht aus einem Verbund gleichartiger oder auch unterschiedlicher Zellen, die gemeinsam eine spezifische Aufgabe erfüllen, sowie der sie umgebenden extrazellulären Matrix. Damit der Gewebeaufbau möglichst lebensähnlich erhalten bleibt, müssen die Proben direkt nach der Entnahme entweder schockgefroren oder mit Hilfe von Formaldehyd fixiert und in Paraffin eingebettet werden. Für histologische Untersuchungen wird das Material dann sehr dünn geschnitten (< 5 µm), auf einen Objektträger aufgezogen und angefärbt, sodass alle Strukturen unter dem Mikroskop gut erkennbar sind.
Neben den klassischen chemischen Farbstoffen, mit denen sich vor allem unterschiedliche Zellbestandteile wie Kerne, Mitochondrien oder auch Kollagenfasern darstellen lassen, werden heutzutage vor allem antikörpervermittelte Färbetechniken eingesetzt. Die verschiedenen Antikörper binden dabei spezifisch an definierte Zielmoleküle, ihre Antigene, bei denen es sich in den meisten Fällen um Proteine handelt. Sind die Antikörper mit einem fluoreszierenden Farbstoff (Fluorochrom) verknüpft, können die Signale mit Hilfe eines Fluoreszenzmikroskops detektiert werden. Da das Verfahren sehr sensitiv und spezifisch ist, lassen sich auf diese Art und Weise auch geringe Mengen des Antigens nachweisen und sogar quantitativ auswerten. Es ist deshalb gut geeignet, um molekulare Biomarker zu analysieren, also Moleküle, die charakteristisch für biologische Vorgänge in den Zellen sind und deshalb als Indikator für Zelleigenschaften dienen.
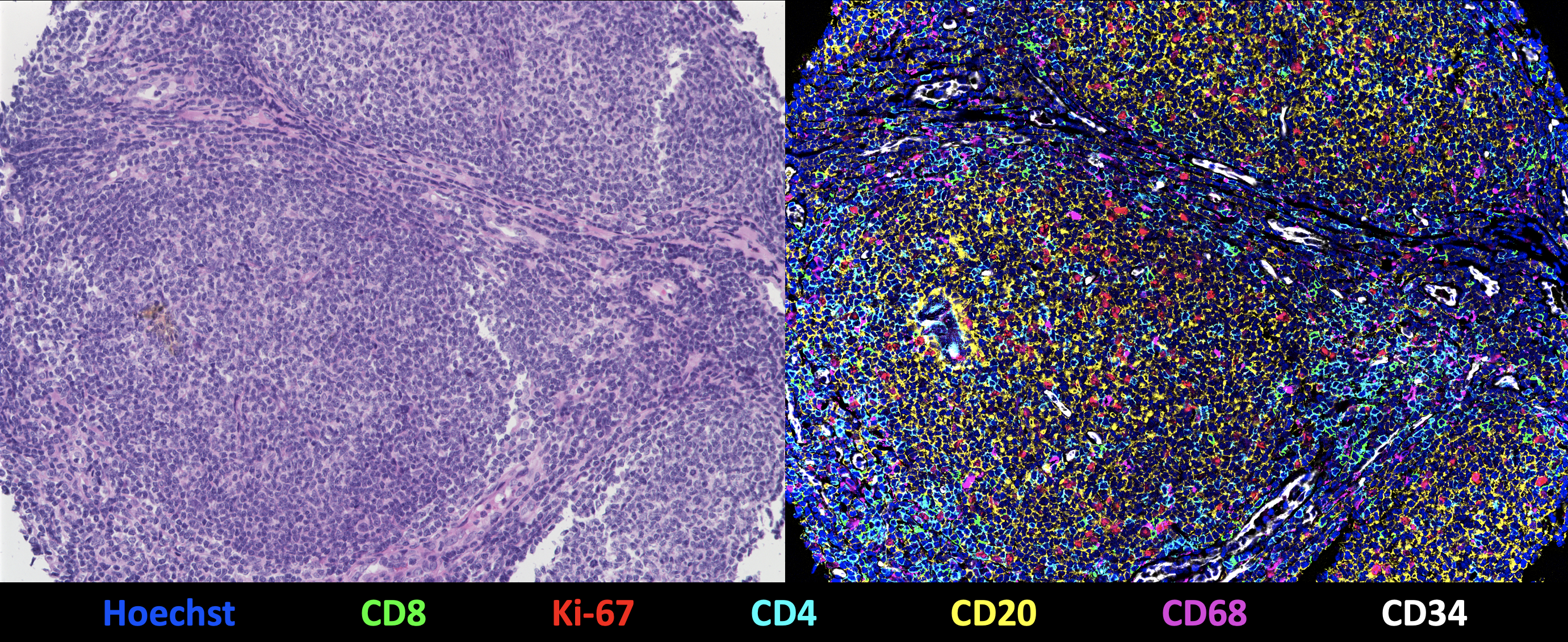 Darstellung des Gewebekerns eines Follikulären Lymphoms durch eine CODEX-Multizyklusreaktion mit 55 Protein- und 2 Kernmarkern. Links: Klassische Hämatoxylin- und Eosinfärbung. Rechts: 7-Plex-Overlay-Bild mit Hoechst (Zellkerne, blau), CD8 (zytotoxische T-Zellen, grün), Ki-67 (Proliferationsmarker, rot), CD4 (T-Helferzellen, cyan), CD20 (B-Zellen / Lymphomzellen, gelb), CD68 (Makrophagen, magenta), CD34 (Gefäße, weiß). Die weiteren 49 Marker sind nicht sichtbar. © Vicinity Bio
Darstellung des Gewebekerns eines Follikulären Lymphoms durch eine CODEX-Multizyklusreaktion mit 55 Protein- und 2 Kernmarkern. Links: Klassische Hämatoxylin- und Eosinfärbung. Rechts: 7-Plex-Overlay-Bild mit Hoechst (Zellkerne, blau), CD8 (zytotoxische T-Zellen, grün), Ki-67 (Proliferationsmarker, rot), CD4 (T-Helferzellen, cyan), CD20 (B-Zellen / Lymphomzellen, gelb), CD68 (Makrophagen, magenta), CD34 (Gefäße, weiß). Die weiteren 49 Marker sind nicht sichtbar. © Vicinity BioMittels neuartiger Bildgebungsverfahren (HMTI, für High-multiplex tissue imaging1)) kann Vicinity Bio in Gewebeproben eine Vielzahl an Biomarkern sichtbar machen. „Wir sind in der Lage, bis zu 200 Marker auf einem einzigen Gewebeschnitt zu detektieren und so ein hochdimensionales Bild zu generieren“, erläutert Wistuba-Hamprecht, dessen Arbeitsgruppe nach vielen Jahren an der Medizinischen Fakultät in Tübingen jetzt an der Universität und am Deutschen Krebsforschungszentrum in Heidelberg ansässig ist. „Im Vergleich zu den gängigen Technologien mit maximal sechs bis sieben Markern eröffnen sich ganz neue Einblicke in die Strukturierung eines Gewebes.“ Möglich ist dies durch iterative Färbezyklen, in denen jeweils bis zu drei verschiedene Biomarker dargestellt werden. Nach jeder Messung werden die fluoreszierenden Verbindungen wieder entfernt und im nächsten Zyklus andere Biomarker visualisiert. Dieser automatisierte Vorgang kann problemlos 50-mal oder öfter wiederholt werden.
Die Forschenden setzen zur Analyse der Schnittpräparate die MACSimaTM-Plattform des deutschen Herstellers Miltenyi Biotec oder die PhenoCycler-Fusion (CODEX)®-Technologie von Akoya Biosciences ein. Letztere nutzt Antikörper, die nicht direkt mit einem Fluorochrom verknüpft sind, sondern über eine kurze DNA-Adaptersequenz temporär gelabelt werden können. Dieses Verfahren wurde im Labor von Prof. Dr. Garry Nolan in Stanford (USA) entwickelt, in dem sowohl Claassen als auch Schürch einige Jahre tätig waren und umfassende Expertise erworben haben.
Einzelzellanalyse mit Hilfe Künstlicher Intelligenz
Die in jedem Zyklus gewonnenen Daten werden zu einem farbigen Bild zusammengesetzt, in dem die einzelnen Zellen und die sie umgebenden Strukturen detailliert dargestellt sind. „Diese bunten Bilder sehen fantastisch aus, sind aber schwer auszuwerten“, schildert Claassen, der die Sektion für Klinische Bioinformatik an der Medizinischen Fakultät der Universität Tübingen leitet. Er forscht an der Schnittstelle zwischen Medizin, Biologie und Informatik und ist vor allem an Einzelzelldaten für die medizinische Anwendung interessiert. „Wir entwickeln Machine Learning Tools, die in den hochdimensionalen Bildern diagnostisch relevante Muster erkennen können.“ Die Rohdaten werden dabei so verarbeitet, dass sich für jede einzelne Zelle ein umfangreicher Datensatz ergibt, der unter anderem die Identifizierung des Zelltyps erlaubt. Auf diese Art und Weise können nicht nur Tumorzellen erkannt, sondern auch die Zellarten in der Nachbarschaft genau bestimmt werden.
Schürch fügt hinzu: „Die Mikroumgebung beeinflusst die Entwicklung eines Tumors entscheidend. Durch unsere detaillierten Informationen über die benachbarten Zellen verbessern wir die Diagnostik enorm und ermöglichen eine zielgerichtete Personalisierte Therapie.“ Er sieht zudem große Chancen, neue diagnostische und prädiktive Biomarker vor allem für Krebsimmuntherapien zu identifizieren.
Schwierige Antikörper-Panel-Etablierung
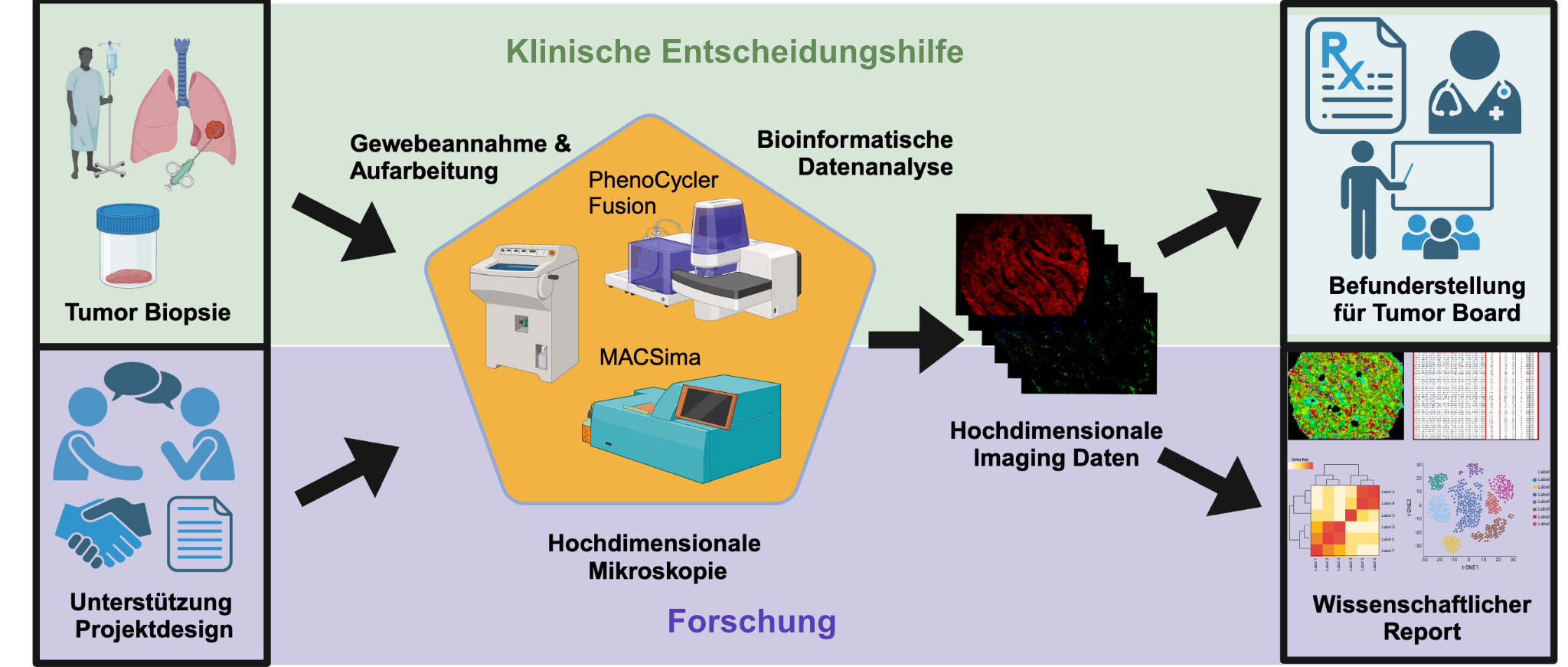 Bei Vicinity Bio befindet sich alles in einer Hand: von der Aufarbeitung der Gewebeproben über die Visualisierung einer Vielzahl an Markern bis zur KI-getriebenen Datenauswertung und der Erstellung von medizinischen Befunden oder wissenschaftlichen Berichten. Zudem bietet das Unternehmen Unterstützung beim Projektdesign.
© Vicinity Bio
Bei Vicinity Bio befindet sich alles in einer Hand: von der Aufarbeitung der Gewebeproben über die Visualisierung einer Vielzahl an Markern bis zur KI-getriebenen Datenauswertung und der Erstellung von medizinischen Befunden oder wissenschaftlichen Berichten. Zudem bietet das Unternehmen Unterstützung beim Projektdesign.
© Vicinity Bio
Preiswürdiges Konzept
Ebenfalls an der Gründung beteiligt war Dr. Aaron Mayer, Mitgründer des in den USA ansässigen Unternehmens Enable Medicine, das auf die Analyse hochdimensionaler Bilder spezialisiert ist. Zudem stehen die Wissenschaftler in engem Austausch mit den Herstellern der Imaging Plattformen.
Mit ihrem Konzept gewann das Team im Juli 2024 den 1. Preis des Science2Start-Ideenwettbewerbs, der jährlich von der BioRegio STERN ausgeschrieben wird.2) Dadurch erhielt es neben Unterstützung beim Schritt in die Selbstständigkeit vor allem Zugang zum regionalen Start-up-Netzwerk.
Vicinity Bio soll auf jeden Fall ein eigentümergeführtes Unternehmen bleiben. „Wir streben ein organisches Firmenwachstum an und wollen das Cyber Valley in Tübingen nachhaltig stärken“, betont Claassen. „Derzeit suchen wir weitere Investoren, die uns dabei unterstützen.“