Projekt REVeyeVE
Zielgerichtete virusfreie Gentherapie fürs Auge mit Hilfe abbaubarer Nanopropeller
Augenerkrankungen, die bereits bei jungen Menschen zur Erblindung führen, werden überwiegend durch Genveränderungen verursacht. Ein interdisziplinäres Forschendenteam der Universitäten Tübingen und Heidelberg entwickelt ein neuartiges gentherapeutisches Verfahren auf der Basis von biologisch abbaubaren und magnetischen Nanopropellern, mit denen intakte Gene effektiv in die betroffenen Zellen geschleust werden sollen.
Weltweit sind etwa 217 Mio. Menschen sehbehindert1), das heißt laut Definition nach deutschem Recht liegt ihr Sehvermögen auf dem besser sehenden Auge selbst mit Brille oder Kontaktlinsen unter 30 Prozent.2) Weitere 36 Mio. Menschen erkennen im Vergleich zu Normalsichtigen weniger als fünf Prozent ihrer Umgebung und gelten damit nach Definition der WHO (World Health Organization) als blind. Da diese Personengruppen in Deutschland nicht erfasst werden, kann die Anzahl der Betroffenen nur auf Basis der WHO-Daten errechnet, bzw. anhand der beantragten Schwerbehindertenausweise abgeschätzt werden. Laut Deutschem Blinden- und Sehbehinderten Verband e.V. sind dies hierzulande zwischen 550.000 und 1,2 Mio. Menschen.2)
In Ländern mit niedrigem Einkommen führen aufgrund der schlechten medizinischen Versorgung vor allem unkorrigierte Fehlsichtigkeit sowie Infektionen, Grauer oder Grüner Star (Katarakt bzw. Glaukom) und auch Diabetes zu schweren Sehbehinderungen. In Deutschland hingegen ist die Altersabhängige Makuladegeneration (AMD) die häufigste Ursache, gefolgt vom Glaukom und diabetischer Retinopathie.1),2)
Gentherapeutische Behandlung bei Augenerkrankungen
 Dr. Sven Schnichels (a), Dr. Jose Hurst (b) sowie Heidi Mühl (c) vom Department für Augenheilkunde des Universitätsklinikums Tübingen entwickeln zusammen mit den beiden PhD-Studierenden Florian Peter (d) und Lucie Motyćkova (e) aus der Arbeitsgruppe von Prof. Dr. Peer Fischer (f) neuartige Nanopropeller für die Gentherapie am Auge. © (a) S. Schnichels | (b) J. Hurst | (c) H. Mühl | (d) und (f) MPI für Intelligente Systeme, (SCO) | (e) L. Motyćkova
Dr. Sven Schnichels (a), Dr. Jose Hurst (b) sowie Heidi Mühl (c) vom Department für Augenheilkunde des Universitätsklinikums Tübingen entwickeln zusammen mit den beiden PhD-Studierenden Florian Peter (d) und Lucie Motyćkova (e) aus der Arbeitsgruppe von Prof. Dr. Peer Fischer (f) neuartige Nanopropeller für die Gentherapie am Auge. © (a) S. Schnichels | (b) J. Hurst | (c) H. Mühl | (d) und (f) MPI für Intelligente Systeme, (SCO) | (e) L. Motyćkova„Erkrankungen der Retina, also der Netzhaut, die bereits in jungen Jahren zur Erblindung führen, sind zumeist genetisch bedingt“, erläutert Dr. Sven Schnichels vom Department für Augenheilkunde des Universitätsklinikums Tübingen. „Sie treten schon im Kindes- oder Jugendalter auf und zeichnen sich durch einen schnell voranschreitenden Abbau der Sehzellen oder retinalen Pigmentepithelzellen aus. Weltweit sind mehr als 2 Mio. Menschen von monogenetischen Netzhauterkrankungen betroffen, das heißt bei ihnen ist nur ein einziges Gen krankhaft verändert. In diesen Fällen kann eine Therapie, die ein funktionsfähiges Gen in die Zellen der Retina einschleust, sehr wirksam sein.“
Seit 2017 ist das erste gentherapeutische Medikament in der Augenheilkunde zugelassen.3) Es wird zur Behandlung der Leberschen kongenitalen Amaurose (LCA) eingesetzt, einer speziellen Form der zur Gruppe der Retinitis Pigmentosa (RP) gehörenden Netzhautdystrophien. Diese beruhen auf Strukturdefekten in verschiedenen Proteinen, die zumeist für die Funktion des Sehpigments Rhodopsin erforderlich sind. Als Folge kommt es zuerst zum Verlust der auf die Lichtwahrnehmung spezialisierten Sinneszellen, der Stäbchen, und später auch der für die Farbwahrnehmung verantwortlichen Zapfen.
Die derzeitige Therapie bei LCA nutzt gentechnisch veränderte Adeno-assoziierte Viren (AAV) als Transportvehikel, um eine intakte Version des bei Betroffenen mutierten RPE65-Gens in die Netzhautzellen zu bringen. Dafür wird im Labor der Großteil des viralen Genoms durch das humane Gen ersetzt. Nach der Injektion der AAV ins Innere des Auges können die Viren vermittelt über ihre äußere Proteinstruktur in die Netzhautzellen eindringen. Dort dient die freigesetzte DNA dann als Vorlage für ein gesundes Protein. Mit dieser Methode lässt sich bei der bisher unheilbaren Erkrankung eine deutliche Verbesserung der Stäbchenfunktion erzielen. Wie lange der Effekt anhält, ist noch unklar.
Virusfreie Nanopropeller als Transportvehikel
 Elektronenmikroskopische Aufnahme eines einzelnen und mehrerer Nanopropeller. © F. Peter, Max-Planck-Gesellschaft
Elektronenmikroskopische Aufnahme eines einzelnen und mehrerer Nanopropeller. © F. Peter, Max-Planck-Gesellschaft„Inzwischen hat sich allerdings gezeigt, dass die Effizienz geringer als gedacht ist und die für den Menschen harmlosen AAV zuweilen Immunreaktionen auslösen können“, berichtet der Biologe. „Zudem ist das Verfahren nicht für größere Gene geeignet. Und, da die Injektionen subretinal, also unter die Netzhaut, erfolgen, ist vorher ein Entfernen des Glaskörpers erforderlich.“ Deshalb begannen er und seine Kollegin Dr. José Hurst zusammen mit der Arbeitsgruppe des Physikers Prof. Dr. Peer Fischer vom Max-Planck-Institut für Medizinische Forschung in Heidelberg bereits 2018, ein alternatives Verfahren zu entwickeln.
Der virusfreie Gentherapieansatz der Forschenden basiert auf sogenannten Nanopropellern. Dies sind winzige spiralförmige Partikel im Größenbereich von Bakterien, die sich aufgrund ihrer magnetischen Eigenschaften antreiben und steuern lassen. In dem vom Bundesministerium für Bildung und Forschung im Rahmen des GO-Bio initial-Programms geförderten Projekt REVeyeVE evaluierten die Beteiligten zunächst die wirtschaftlichen Aspekte ihres Vorhabens, bevor sie den Proof-of-Principle erbrachten.
Im ersten Forschungsabschnitt wurde die Herstellung der Partikel aus biodegradierbarem Material etabliert. „Unsere etwa 1200 nm großen Propeller bestehen aus Magnesium und Zink und können bis auf den eisenhaltigen Kern vom Körper abgebaut und teilweise sogar verwertet werden“, führt Doktorand Florian Peter aus Heidelberg aus. „Abhängig vom Verhältnis der beiden Komponenten zueinander haben sie eine Lebensdauer zwischen 24 Stunden und einem Monat und lassen sich somit an die jeweilige Therapie anpassen.“ Außerhalb des Körpers sind die Teilchen über Monate bei Raumtemperatur stabil.4)
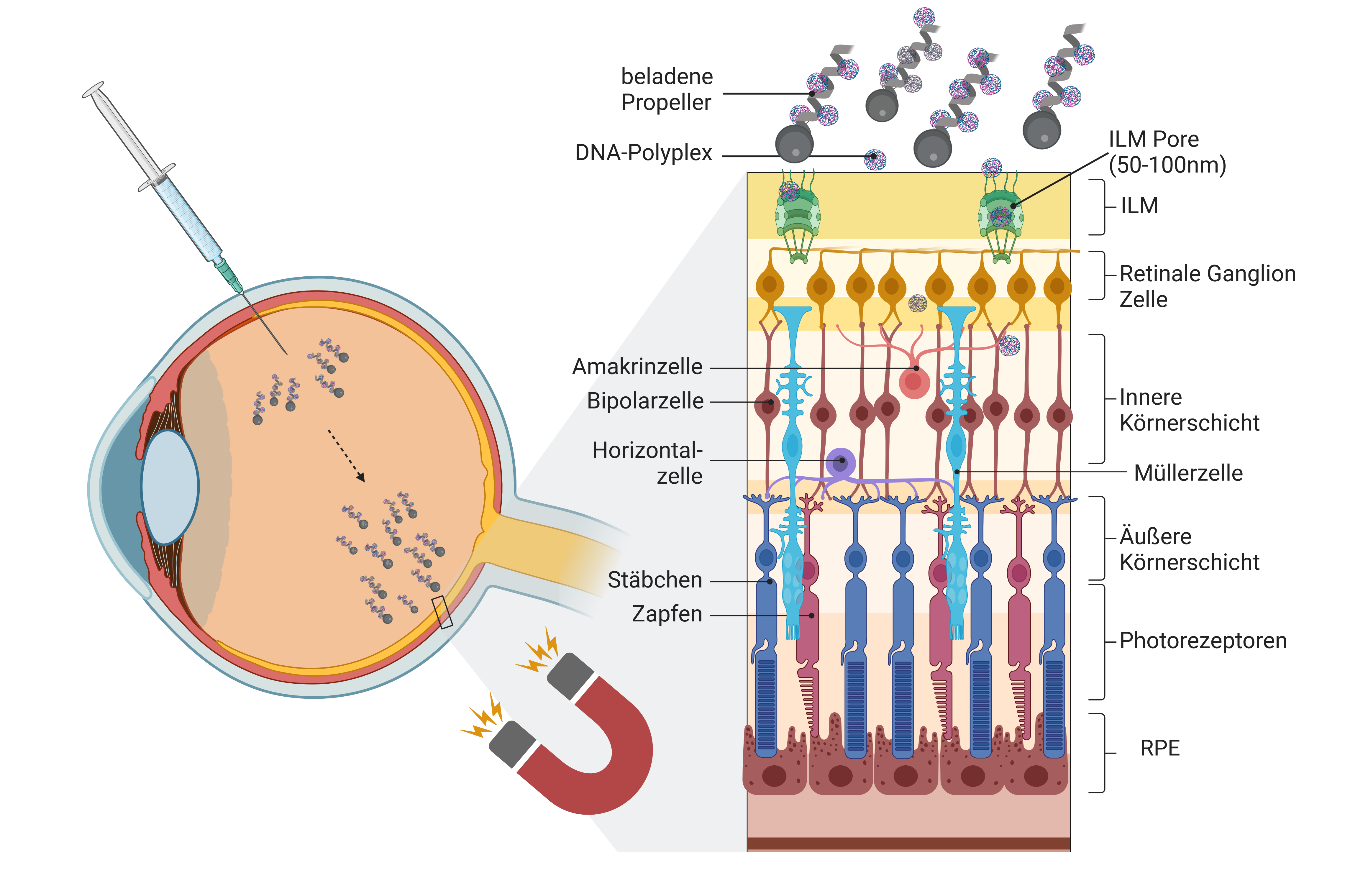 Nach Injektion in den Glaskörper des Auges werden die Nanopropeller mittels eines MRT-ähnlichen Magnetfeldes gezielt zur Netzhaut navigiert. Die Propeller sind mit Nukleinsäuren für die Gentherapie (DNA- oder RNA-Moleküle) beladen, die durch synthetische Polymere zu sogenannten Polyplexen kondensiert wurden, um den Transport zu ermöglichen. Diese nanostrukturierten Polyplexe können durch die Poren der inneren Grenzmembran (ILM) in die Netzhaut eindringen, wo sie von den Zellen aufgenommen werden. Die Freisetzung der Nukleinsäuren erfolgt durch den Abbau der Polyplexe. © S. Schnichels, J. Hurst, erstellt mit BioRender.com
Nach Injektion in den Glaskörper des Auges werden die Nanopropeller mittels eines MRT-ähnlichen Magnetfeldes gezielt zur Netzhaut navigiert. Die Propeller sind mit Nukleinsäuren für die Gentherapie (DNA- oder RNA-Moleküle) beladen, die durch synthetische Polymere zu sogenannten Polyplexen kondensiert wurden, um den Transport zu ermöglichen. Diese nanostrukturierten Polyplexe können durch die Poren der inneren Grenzmembran (ILM) in die Netzhaut eindringen, wo sie von den Zellen aufgenommen werden. Die Freisetzung der Nukleinsäuren erfolgt durch den Abbau der Polyplexe. © S. Schnichels, J. Hurst, erstellt mit BioRender.comEine ausgezeichnete biologische Verträglichkeit der Propeller wurde im Labor bestätigt, und die Beladung der Propeller mit DNA ist inzwischen gelungen. „Da nicht nur das eigentliche Gen, sondern auch regulatorische Sequenzen in die Zellen geschleust werden müssen, besitzen die ringförmigen Nukleinsäuremoleküle, die Plasmide, Durchmesser von bis zu 1500 nm und können größer als das Transportvehikel sein“, so Hurst. Um die Plasmide zu verkleinern, nutzen die Forschenden synthetische Polymere, die zusammen mit der DNA sogenannte Polyplexe formen. In diesen liegt das genetische Material in eng gepacktem kondensiertem Zustand mit einer reduzierten Größe von 20 - 50 nm vor. Ein Nanopropeller wird voraussichtlich bis zu zehn solcher Polyplexe binden und befördern. Die Freisetzung der Ladung erfolgt dann im Zuge des Abbauprozesses.
Hurst hebt hervor: „Aktuell arbeiten wir mit einem Plasmid, welches das Rhodopsingen kodiert. Prinzipiell kann mit unserer Technologie aber jede Nukleinsäure verpackt werden, beispielsweise auch verschiedene RNA-Varianten. Wir stellen kein spezifisches Therapeutikum her, sondern konzentrieren uns auf die Etablierung der Plattform sowie die Optimierung der Verpackungseinheit und deren Bindung an die Nanopartikel.“
Innovatives Drug-Delivery-System mit viel Potenzial
Aufgrund der vielversprechenden Ergebnisse wurde das Projekt REVeyeVE im Juli 2024 mit dem 2. Preis des Science2Start-Ideenwettbewerbs ausgezeichnet, der jährlich von der BioRegio STERN ausgeschrieben wird.5) Zudem wurde die Förderung um weitere sechs Monate bis Ende März 2025 verlängert. „Wir starten jetzt mit der präklinischen Anwendung und müssen noch die magnetische Steuerung und Beladung ausarbeiten“, erklärt Schnichels. Die notwendigen Experimente finden zunächst an isolierten Schweineaugen statt, da diese in Aufbau und Größe dem menschlichen Auge sehr ähneln. Nach Injektion in den Glaskörper sollen die Nanopropeller mit Hilfe von Magnetfeldern zu den Zielzellen dirigiert werden. „Wir verwenden kleine Felder, die man mit Magnetspulen steuern kann“, so Doktorandin Lucie Motyćkova aus Heidelberg.
Das Team ist optimistisch, das Verfahren in den nächsten Jahren so weit zu etablieren, dass Klinische Studien durchgeführt werden können. Da mit den Nanopropellern jegliche Arten von Nukleinsäuren ohne wesentliche Größenbeschränkung zielgerichtet transportiert werden können, ist ein breites Einsatzgebiet auch außerhalb des Auges denkbar.